| |
| 1. INTRODUCERE ÎN TEORIA COMBUSTIEI
1.1. Chimia si fizica procesului
de combustie
Din punct de vedere chimic, combustia
este un proces exoterm de oxidare, în care anumite substante
reactioneazã, mai mult sau mai putin violent, când se combinã
cu oxigenul în stare liberã si care duce la producerea unei
mari cantitãti de cãldurã si, frecvent, de luminã.
Substantele care reactioneazã
în acest mod sunt denumite combustibili, iar reactia este
cunoscutã sub numele de combustie. Se considerã cã
oxigenul, fãrã de care combustia nu poate avea loc, întretine
arderea.
Principalele componente care sunt
prezente în combustibilii utilizati în mod curent sunt: carbonul
(C), hidrogenul (H2), monoxidul de carbon (CO), metanul (CH4),
alte hidrocarburi în afarã de metan (CmHn),
oxigenul
(O2), azotul (N2), dioxidul de carbon (CO2)
si apa (H2O).
Printre aceste componente, cele
combustibile reactioneazã în conformitate cu urmãtoarele
reactii chimice:
C + O = CO2 + 394 kJ
/ mol
S + O2 = SO2
+ 297 kJ / mol
2 H2 + O2
= 2 H2O + 242 kJ / mol
CO + 1/2 O2 = CO2
+ 283 kJ / mol
CH4 + 2 O2 =
2 H2O + CO2 + 803 kJ / mol
CmHn + (m
+ n/4) O2 = n/2 H2O + m CO2 + xxx kJ /
mol (*)
Oxigenul necesar reactiilor de combustie
este asigurat de aerul atmosferic, a cãrui compozitie medie este
datã în urmãtorul tabel: |
Compozitia medie a aerului
atmosferic
(aer uscat la 273 K, 1013 mbar)
| |
Masã molecularã
MW
|
% volum
(m3 / m3)
|
% masã
(kg / kg)
|
| Azot, N2 |
28
|
78,08
|
75,52
|
| Oxigen, O2 |
32
|
20,95
|
23,15
|
| Argon, A |
40
|
0,93
|
1,28
|
| Dioxid de
carbon, CO2 |
44
|
0,03
|
0,046
|
| Altele |
|
0,01
|
0,004
|
În calculul reactiilor de
combustie, se presupune cã aerul are urmãtoarea compozitie:
N2 = 79% (procentaj de
volum)
O2 = 21%
Posibilitatea fiecãrui combustibil
de a-si elibera energia termicã este definitã de cãldura
sa specificã de combustie. În general, putem spune cã
puterea caloricã reprezintã cantitatea de cãldurã
care este eliberatã în procesul de combustie de cãtre
1 livrã de combustibil lichid sau solid, sau de cãtre un
picior cubic standard de combustibil gazos.
Existã douã puteri
calorice diferite:
-
puterea caloricã superioarã
-
puterea caloricã inferioarã.
Diferenta dintre aceste douã
valori reprezintã cãldura latentã de condensare a
apei produse pe durata procesului de combustie.
Deoarece apa este întotdeauna
prezentã în produsele de combustie, este necesar sã
se elibereze vaporii de apã sub formã de condens (anume sub
formã de apã lichidã), pentru a obtine cantitatea
maximã de cãldurã pe care o poate genera potential
orice combustibil (puterea caloricã superioarã).
În general, în procesul
de combustie apa produsã este eliberatã în atmosferã
sub formã de vapori în gazele arse, (ca urmare cãldura
produsã prin condensarea apei se pierde, iar cãldura disponibilã
este doar puterea caloricã inferioarã a combustibilului respectiv).
Sã analizãm reactia
de combustie a metanului:
CH4 + 2 O2 = 2 H2O + CO2 +
cãldurã
Pentru un gaz perfect, un mol de
gaz în conditii normale (0°C, 1 atm) are întotdeauna acelasi
volum, anume 22,414 litri.
Ca urmare, este posibil sã
se considere o reactie chimicã dintre substante gazoase ca fiind
o reactie chimicã dintre volumele substantelor respective.
Dacã ne reamintim cã
în aer existã 21% volume de oxigen, avem:
1 m3CH4 +
(2 m3O2 + 7,52 m3N2) = 2 m3H2O
+ 1 m3CO2 + 7,52 m3N2 + cãldurã
Deci, pentru fiecare m3
de metan, cantitatea de aer teoretic care este necesarã pentru a
permite reactiei sã aibã loc este de (2 + 7,52) = 9,52 m3.
Considerând ecuatiile chimice
de combustie mentionate mai sus:
1 m3 CH4 necesitã
2 m3O2
1 m3 H2 necesitã
0,5 m3O2
1 m3 CO necesitã
0,5 m3O2
1 m3 CmHn
necesitã (m + n/4) m3 O2
Referindu-ne la volumul de aer,
cantitatea necesarã de aer stoichiometric este:
1 m3 CH4 necesitã
9,52 m3 de aer stoichiometric
1 m3 H2 necesitã
2,38 m3 de aer stoichiometric
1 m3 CO necesitã
2,38 m3
de aer stoichiometric
1 m3 CHn necesitã
4,76 (m + n/4) m3 de aer stoichiometric
Pentru combustibili în formã
gazoasã, dacã definim:
[CO], [H2], [CH4],
[CmHn], [O2] procentajul volumetric al
fiecãrei componente care este prezentã în amestecul
de gaz combustibil, avem:
Volumul de aer teoretic Atv = [CO]
x 2,38/100 + [H2] x 2,38/100 + [CH4] x 9,52/100 +
4,76 x [SUMAi(mi + ni/4) x CmHn]/100 - 4,76 x [O2]/100,
în care ultimul termen ia
în considerare cantitatea de oxigen eventual prezentã în
combustibil.
În practicã nu va fi
niciodatã posibil sã se lucreze cu cantitatea stoichiometricã
de aer, dar va fi necesar sã se utilizeze o cantitate de aer efectiv
care este întotdeauna mai mare decât cea teoreticã.
Elementele esentiale ale combustiei
sunt:
-
combustibilul
-
aerul de combustie (oxigenul)
-
amorsa pentru aprindere
Pentru a initia arderea nu este necesar
doar sã existe un contact între combustibil si aer, ci trebuie
sã existe, de asemenea, un agent de amorsare a reactiei, ceea ce
înseamnã cã o parte a combustibilului trebuie sã
aibã o temperaturã mai mare decât punctul sãu
de aprindere. Combustia va satisface
regula "3T", anume:
-
timp (scurt)
-
temperatura (ridicatã)
-
turbulentã (mare)
Se cere o turbulentã considerabilã
pentru un contact optim între combustibil si aer, astfel încât
sã se obtinã arerea completã a combustibilului, pentru
a asigura o flacãrã de înaltã temperaturã
si un timp scurt de combustie.
Turbulenta scãzutã
duce la un amestec necorespunzãtor între combustibil si aer,
astfel încât este posibil ca procesul de combustie sã
nu fie complet, asigurând o flacãrã de temperaturã
foarte redusã, iar combustibilului îi trebuie un timp îndelungat
ca sã ardã (ca urmare apar hidrocarburi nearse).
1.2. Combustia în practicã
Amestecul perfect între combustibil
si aer nu survine întotdeauna, chiar si în conditii bune de
amestec. Câteodatã, amestecarea dureazã prea mult,
astfel cã amestecul ajunge într-o zonã în care
temperatura este prea scãzutã pentru a furniza suficientã
cãldurã în vederea definitivãrii combustiei.
Dacã se furnizeazã
doar cantitatea de aer stoichiometric, o parte a combustibilului nu arde
si combustia rãmâne incompletã. Pentru a asigura o
combustie completã, se furnizeazã aer în exces fatã
de cantitatea stoichiometricã. În acest mod, fiecare moleculã
de combustibil gãseste numãrul corect de molecule de oxigen
necesare pentru încheierea combustiei.
Acest aer adãugat este denumit
aer în exces, deci cantitatea efectivã de aer este
egalã cu aerul teoretic plus aerul în exces.
Cantitatea de aer în exces
utilizatã pentru combustia practicã depinde în general
de mai multi factori (natura si starea fizicã a combustibilului,
forma camerei de combustie, tipul de arzãtor etc.); cantitatea de
aer în exces este mare pentru combustibilii solizi si are valori
mai mici pentru combustibilii lichizi sau gazosi.
Am stabilit cã respectivele
conditii optime pentru a garanta combustia completã a unor cantitãti
mari de combustibil într-un spatiu limitat si în timp scurt
presupun sã se lucreze cu aer în exces fatã de necesarul
de aer teoretic.
Dorim sã subliniem acum cã
ocombustie optimã se realizeazã cu cea mai redusã
cantitate de aer în exces posibilã.
Aer în exces înseamnã
cã o parte din oxigen, nefiind utilizatã, va deveni o parte
a fluxului de gaze arse, ducând la cresterea volumului total al acestuia.
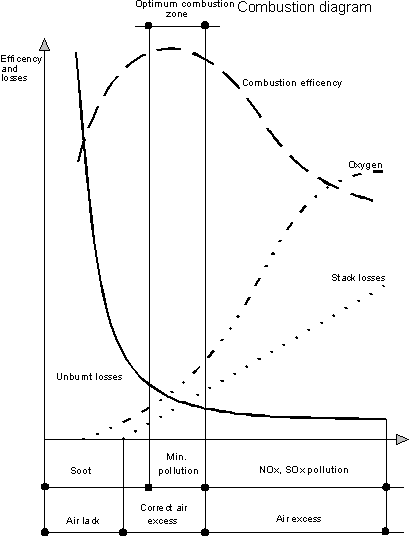
Existã deci o valoare optimã pentru aerul în exces.
În cazul în care cantitatea
de aer este prea micã, va fi prezent combustibil nears, datoritã
combustiei incomplete (înregistrându-se astfel o risipã
de combustibil si pericolul poluãrii atmosferei), în vreme
ce o cantitate prea mare de aer produce o combustie completã, dar
vor exista pierderi mai mari la cos (ducând la scãderea eficientei
si la cresterea emisiei de oxizi de azot). Zona optimã este cea
care combinã poluarea minimã cu cele mai reduse niveluri
de combustibil nears si de pierderi la cos.
1.3. Procentajul de oxigen si
aer în exces în gazele arse
Controlul aerului în exces
este important pentru garantarea unei combustii corespunzãtoare.
Prin mãsurarea oxigenului prezent în gazele evacuate, este
posibil sã se determine procentajul corect de aer în exces.
Mãsurarea procentajului de oxigen din gazele evacuate a înlocuit
sistemul bazat pe mãsurarea procentajului de CO2.
Aceasta
se datoreazã urmãtoarelor:
-
oxigenul reprezintã o parte a
aerului, în cazul în care continutul de oxigen este zero cantitatea
de aer în exces este zero;
-
când se lucreazã cu lipsã
de aer, procentajul de CO2 creste proportional cu cresterea
cantitãtii de aer dar, dupã un maxim, procentul de CO2
scade odatã cu cresterea cantitãtii de aer, aceasta înseamnã
cã acelasi procentaj de CO2 corespunde la douã
niveluri diferite ale cantitãtii de aer de combustie;
-
flexibilitatea functionalã ridicatã
a sondei cu oxid de zirconiu a revolutionat si simplificat mãsurarea
cantitãtii de oxigen.
1.4. Gaze umede si gaze uscate
Apa este prezentã în
fluxul de gaze evacuate sub formã de abur, care este produs prin
combustia hidrogenului, de apa prezentã în combustibil si
de umiditatea din aerul de combustie. Un asemenea gaz se numeste umed.
Dacã gazul este rãcit
la temperatura mediului ambiant, umiditatea condenseazã în
formã lichidã. Gazul astfel separat se numeste
uscat.
1.5. Constante caracteristice
ale combustibilor
Fiecare tip de combustibil este caracterizat
de unele constante specifice. Aceste constante sunt:
a raportul dintre volumul
de gaze arse si volumul aerului de combustie (per unitatea de combustibil),
relevant pentru combustia stoichiometicã (umed).
b raportul dintre volumul de
gaze arse si volumul aerului de combustie (per unitatea de combustibil),
relevant pentru combustia stoichiometicã (uscat).\
c procentul
maxim volumetric al continutului de CO2 în gazele arse
(uscat) pentru combustia stoichiometricã.
d procentul
pierderilor datorate cãldurii latente (pierderi de umiditate).
e factorul
de combustie relevant pentru compozitia combustibilului.
|
| Tabelul urmãtor prezintã
constantele combustibililor cel mai frecvent utilizate: |
|
Combustibil
|
A
|
b
|
C
|
d
|
E
|
| Gaz natural |
1,105
|
0,895
|
11,7
|
11
|
0,38
|
| Propan |
1,084
|
0,916
|
13,8
|
7,7
|
0,42
|
| LPG |
1,091
|
0,912
|
14
|
7,4
|
0,43
|
| Titei |
1,068
|
0,936
|
15,1
|
6,1
|
0,56
|
| LFO |
1,067
|
0,94
|
15,6
|
6,0
|
0,56
|
| HFO |
1,065
|
0,944
|
15,8
|
5,8
|
0,58
|
| Cãrbune |
1,03
|
0,98
|
19,1
|
2,7
|
0,67
|
| Lemn |
1,2
|
0,99
|
20,1
|
12,5
|
0,58
|
|
|